Kinetika Kimia Orde 0 Dan 1 Secara Matematis

Kinetika Kimia Orde 0 Dan 1 Secara Matematis Youtube Orde pertama. orde pertama adalah laju reaksi bergantung pada satu reaktan dan jumlah eksponennya satu. contohnya, dalam reaksi ion arildiazonium dengan nukleofil dalam larutan berair arn 2 x − → arx n 2, persamaannya adalah r = k [arn 2 ], dan ar merupakan kelompok aril. contoh reaksi orde pertama lainnya adalah proses peluruhan. Reaksi – reaksi yang berlangsung terlalu cepat atau terlalu lama tidak dapat diamati atau di ukur secara kinetika kimia. dalam tulisan kali ini kita akan mempelajari mengenai orde reaksi, reaksi orde nol, reaksi orde satu, reaksi orde dua, reaksi orde tiga, reaksi orde semu dan reaksi orde autokatalis.

Kimia Dasar Kinetika Kimia Orde 0 1 Dan 2 Youtube Dari kedua plot (orde 0 dan orde 1) maka diperoleh : plot orde 0 : y = 2,28x 101 dengan r2 = 0,996 plot orde 1 : y = 0,0303x 4,6391 dengan r2 = 0,9762 dari kedua plot tersebut maka reaksi tersebut mempunyai orde 0 r2 lebih mendekati 1 dibanding r2 pada plot orde 1. sehingga persamaan reaksi penurunan vitamin c adalah :. Untuk itu, wardaya college ingin membantu kamu untuk memahami materi ini dengan tepat dan benar, termasuk penghitungan rumus laju reaksi. ada video pembelajaran yang akan membantu kamu memahami materi. selain itu, kamu bisa mengerjakan contoh soal kinetika reaksi yang ada di wardaya college. 2. Dalam contoh ini, orde reaksi reaktan hgcl. 2. adalah 1 dan orde reaksi ion oksalat adalah 2; orde reaksi secara keseluruhan adalah 1 2 = 3. orde reaksi di sini (1 dan 2) berbeda dengan koefisien stoikiometrinya (2 dan 1). orde reaksi hanya bisa ditentukan lewat percobaan. dari situ dapat ditarik kesimpulan mengenai mekanisme reaksi. Suatu reaksi dekomposisi b c yang merupakan reaksi orde nol. pada suhu 300, 200 mg sampel a mengalami pengurangan massa menjadi 43,5 mg selama lima belas menit. berapa lama waktu yang diperlukan agar zat a mengalami dekomposisi 90. belajar modul, rumus, & soal orde reaksi & waktu paruh dan kuis interaktif.

Kinetika Kimia Part 4 Hukum Laju Terintegrasi Orde 1 Youtube Dalam contoh ini, orde reaksi reaktan hgcl. 2. adalah 1 dan orde reaksi ion oksalat adalah 2; orde reaksi secara keseluruhan adalah 1 2 = 3. orde reaksi di sini (1 dan 2) berbeda dengan koefisien stoikiometrinya (2 dan 1). orde reaksi hanya bisa ditentukan lewat percobaan. dari situ dapat ditarik kesimpulan mengenai mekanisme reaksi. Suatu reaksi dekomposisi b c yang merupakan reaksi orde nol. pada suhu 300, 200 mg sampel a mengalami pengurangan massa menjadi 43,5 mg selama lima belas menit. berapa lama waktu yang diperlukan agar zat a mengalami dekomposisi 90. belajar modul, rumus, & soal orde reaksi & waktu paruh dan kuis interaktif. Reaksi orde 1 adalah reaksi yang lajunya secara langsung tergantung pada konsentrasi satu reaktan. untuk menghitung laju reaksi orde 1, kita dapat menggunakan rumus rate = k [a]. konstanta laju reaksi orde 1 (k) bergantung pada suhu dan sifat sifat reaktan yang digunakan. semakin tinggi konsentrasi reaktan, semakin cepat reaksi akan berlangsung. Kinetika kimia. rusman. syiah kuala university press, mar 19, 2020 science 104 pages. setelah membaca buku ini diharapkan pembaca dapat memahami tentang laju reaksi, hukum laju, membedakan orde reaksi, mendeferensialkan persamaan reaksi ordegrafik, serta peran katalis fungsi katalis. buku ini diharapkan dapat membantu mahasiswa yang.
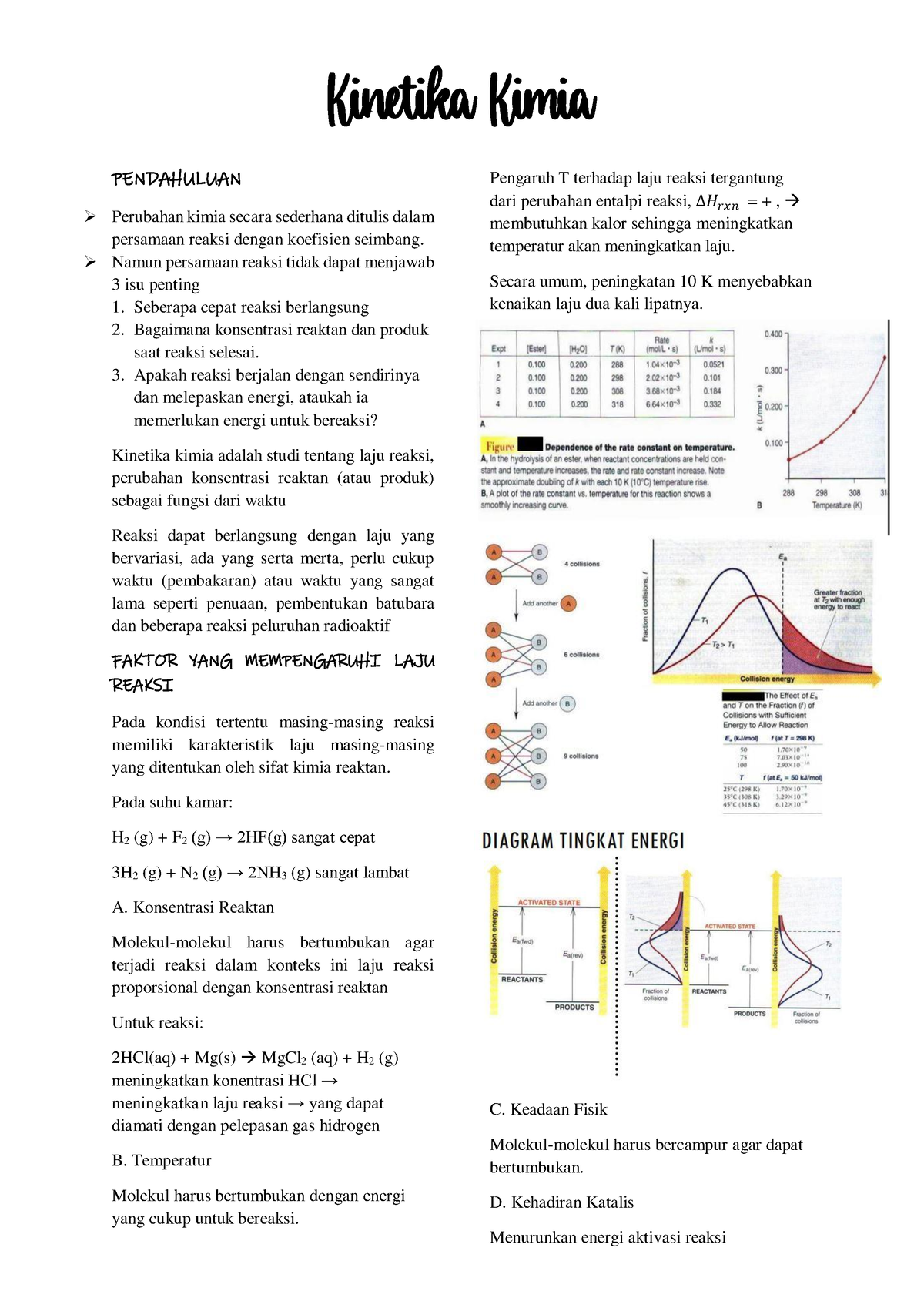
Rangkuman Kinetika Kimia Part 1 Dan 2 Kinetika Kimia Pendahuluan Reaksi orde 1 adalah reaksi yang lajunya secara langsung tergantung pada konsentrasi satu reaktan. untuk menghitung laju reaksi orde 1, kita dapat menggunakan rumus rate = k [a]. konstanta laju reaksi orde 1 (k) bergantung pada suhu dan sifat sifat reaktan yang digunakan. semakin tinggi konsentrasi reaktan, semakin cepat reaksi akan berlangsung. Kinetika kimia. rusman. syiah kuala university press, mar 19, 2020 science 104 pages. setelah membaca buku ini diharapkan pembaca dapat memahami tentang laju reaksi, hukum laju, membedakan orde reaksi, mendeferensialkan persamaan reaksi ordegrafik, serta peran katalis fungsi katalis. buku ini diharapkan dapat membantu mahasiswa yang.

Comments are closed.